Part 1 기기 정의
Nuclear Magnetic Resonance Spectroscopy (NMR) 또는 핵자기 공명 분석법은 자기장 속에 놓인 원자핵이 특정 주파수의 전자기파와 공명하는 현상을 통하여 분자의 물리, 화학, 전기적 성질을 알아낼 수 있는 분석방법이다. [a] NMR을 가장 많이 사용하는 화학 분야에서는 주로 타겟 원자의 원자핵이 반응한 특정 주파수의 전자기파를 분석하여 현미경 및 전자현미경으로는 관측할 수 없는 구조 및 원자간 결합 등 관측 할 수 있다는 장점이 있다. 더 나아가 IR Spectroscopy 및 UV Spectroscopy와 함께 사용하여 구조 예측의 정확도를 올리며 좀 더 복잡한 구조를 예측할 수 있다.
Part 2 원리 및 구조
1) NMR의 구조
NMR의 구조는 아래의 그림 (a)와 같다.

[그림 a] NMR의 보편적 구조
NMR은 크게 액체 질소 자켓, 액체 헬륨 자켓, 시료 투입관, 전자석으로 이루어져있다. 가장 핵심적인 부품은 초전도 자석으로, 원자를 정렬하기 위하여 매우 강력한 자기장을 걸어준다. 초전도 자석은 극저온의 환경을 유지하는 것이 매우 중요한데, 극저온의 환경은 전류가 흐르면서 발생하는 열을 잡아주는 동시에 초전도체의 내부 저항을 거의 0에 가깝게 만들어주기 때문이다. 극저온의 환경은 시료 투입 관의 외부에 있는 헬륨 자켓의 액체 헬륨을 통해 유지된다. 액체 헬륨은 온도를 낮추는데 매우 효과적이지만, 온도가 조금이라도 높아지는 순간 퀜칭(Quenching)이 일어나서 급격한 부피팽창이 일어나며 자켓이 터지거나, 주변의 산소가 전부 밀려나서 인명사고가 발생할 수 있는 등의 문제가 있다. 이를 방지하는 안전장치로 액체 질소를 헬륨 자켓의 외부에 두어 급격한 열의 흡수를 방지하며, 액체 헬륨이 소비되는 속도를 늦춘다
2) 분석원리
(1) 원자핵의 특성
NMR의 기본 분석 원리는 Radio Frequency (RF)로 인한 원자핵 spin의 변화 (spin flip)를 관측하는 것이다. 하지만 NMR은 모든 원자를 관측 할 수 있는 것이 아니라, spin이 상쇄되어 각 운동량 스핀 양자수가 0이 되는 경우 관측할 수 없다. 이는 간단하게 말해서 중성자 수와 양성자 수가 전부 짝수인 경우 관측할 수 없다는 얘기이다(ex. 12C6, 16O8 등). NMR로 관측할 수 있는 원자핵은 1H1, 13C6, 15N7 등이 있다.
(2) 자기장의 작용
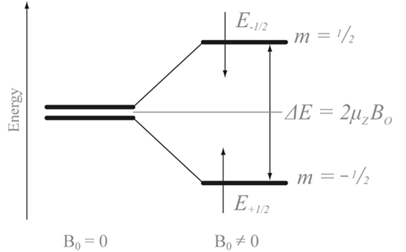
자연상태에서의 원자핵의 스핀은 무작위의 벡터로 자유롭게 놓여져 있는데. 원자핵에 매우 강력한 자기장을 걸어주게 된다면, 원자핵의 스핀은 자기장을 따라서 업스핀(Alpha State) 또는 다운스핀(Beta State)으로 정렬하며 에너지 궤도가 두 개로 갈라지는 현상이 일어난다. 이 때 Alpha state는 낮은 에너지 궤도로, beta state는 높은 에너지 궤도로 나눠지며, 이 효과를 Zeeman effect라고 한다. Alpha state와 beta state의 개수 비는 자기장에 세기에 따라서 볼츠만 분포로 나타나게 된다.
(3) Radio Frequency (RF)의 작용
전자기파는 원자에 에너지를 주어 활성상태로 만들 수 있다. 전자기파의 종류 중 하나인 RF는 NMR에서 원자핵에 에너지를 주어 Alpha State의 원자핵 스핀을 Beta state로 활성화 시키며, 이 현상을 spin flip이라고 한다. 이 때 RF의 공급을 멈추게 되면, 활성화된 spin은 에너지를 잃게 되고, 이때 에너지를 전자기파의 형태, RF의 형태로 방출하게 된다. NMR은 여기서 방출된 에너지를 측정하여 분석결과를 나타낸다.
(4) Spin flip
원자핵 스핀의 방향이 뒤집어지는 spin flip이 일어나기 위해서 필요한 에너지는 각각의 원자마다 전부 다르다. 자기장의 세기, 원자의 종류, 결합의 세기, 등에 따라 매우 큰 차이를 보이며, 이 차이를 통해 NMR 분석을 진행할 수 있다. Spin flip이 일어나기 위해 필요한 에너지는 아래 수식 (a)와 같다.
∆E=hv=h(γ/2π)B0----- (a)
이 때 h는 플랑크상수, v는 진동수를 나타낸다. 여기서 진동수는 γB0/2π로 나타낼 수 있으며, γ는 각진동수, B0는 원자가 느끼는 자기장의 세기이다. . 하지만 원자가 느끼는 자기장의 세기는 외부의 자기장의 세기만큼 영향을 받지 않는다. 원자 주변의 전자들로 인하여 가리움 효과가 일어나며, 원자 주변의 전자로 인한 자체 자기장으로 인하여 원자가 받는 자기장의 세기는 외부 자기장의 세기보다 훨씬 감소한다. 이를 아래 수식 (b)와 같이 나타낼 수 있다.
Beffective=Bapplied-Blocal-----(b)
Bapplied는 외부 자기장의 세기이며, Blocal은 원자 자체의 자기장의 세기이다. 여기서 전자의 가리움 효과 및 원자의 전자 자체의 자기장이 세지면 Beffective이 작아진다고 생각하면 된다.
(5) NMR 피크
측정된 NMR 피크는 Spin flip으로 방출된 RF의 에너지 크기에 따라 아래 그림 (g)처럼 다르게 나타난다. 여기서 0ppm은 기준물질인 TMS로, 전자 가리움 효과가 매우 강력하여 외부 자기장의 영향을 거의 받지 않는다.

[그림 g] DBU와 MEA의 혼합물 NMR
검출된 주파수는 아래 수식 (c)에 대입되어 구해진의 δ값이 NMR 피크로 나타나진다. [b]
δ=TMS와 공명주파수의 차이 (Hz) / NMR이 가한 주파수(MHz) -----(c)
(6) Chemical shift
위의 spin flip 설명에 나온 것처럼, Beffective는 전자의 가리움 효과 및 원자 자체의 자기장에 따라 달라지기 때문에 같은 원소라도 다른 위치에 피크가 나타나게 한다. 피크가 shift하는 요인에는 크게 전자의 가리움 효과와 magnetic anisotropy가 있다. 우선 전자의 가리움 효과에 의한 영향을 보자. 전자 밀도가 높으면 전자의 가리움 효과가 강하여 외부 자기장의 영향을 덜 받게 된다. 반대로 전자 밀도가 낮으면 전자의 가리움 효과가 약해져 외부 자기장의 영향을 많이 받게 된다. 예를 들어 전자 친화도가 높은 산소, 플루오린, 질소 같은 원소와 결합한 수소원자는 전자가 치우치게 되어서 전자 밀도가 낮아지며, 이로 인하여 가리움 효과가 약해진다.따라서 Beffective가 커지고, 이로 인하여 NMR의 피크는 왼쪽으로 이동하며, 이를 deshielding되어 downfield로 이동하였다고 한다. 반대로 Shielding되어 upfield로 이동하는 경우를 확인해보자. Primary carbon은 tertiary carbon보다 전자밀도가 높아서 가리움 효과가 강해져 Beffective가 작아지고, 이로 인하여 shielding된다. 상자성 및 반자성 분자의 다중 결합 또한 Beffective에 영향을 미친다. 이를 Magnetic anisotropy라고 하며, 다중결합의 π결합과 자기장의 작용으로 일어나는 현상이다. 이는 분자 구조 및 주어진 자기장의 효과에 따라 각각 다르므로 직접 확인이 필요하다. 예를 들어 벤젠의 경우, 자기장이 주어지면 이중결합으로 인한 공명구조가 Bapplied를 감소시켜 피크가 downfield로 이동하게 된다.
(7) Chemical equivalence
NMR은 chemical equivalence의 원리를 통하여 비율분석이 가능하다. Chemical equivalence는 동일한 δ값을 가진 원자들은 피크가 동일한 위치에 원자의 수에 비례한 면적으로 누적되어 나타나는 원리이다. 같은 ppm의 피크가 두 개가 있을 때, 이 두 개는 같은 위치에서 합쳐져서 두 배의 넓이를 가진 피크가 나타나는데, 보통 높이가 높아지듯이 나타난다. NMR 피크의 넓이 비율을 integration curve로 간략하게 나타내며, 이를 통해 원자의 비율을 분석할 수 있다.
(8) Spin splitting
원자 자체의 자기장으로 인한 전자밀도의 변화로, chemical shift가 일어나는 것처럼 주변의 가까운 원소부터 먼 원소까지 주변 원소들의 영향에 따라서 chemical shift가 일어나기도 한다. 특히 가까운 거리의 원자들끼리는 서로의 스핀 방향에 따라 chemical shift현상이 발생하게 된다. 같은 방향의 스핀이면 원자의 local 자기장이 보강간섭을 하며, 반대 방향이면 상쇄간섭을 하여 영향을 미친다. 제일 보편적으로 일어나는 splitting은 (n+1) 법칙으로 불리며, 이는 한 수소가 연결된 탄소에 이웃한 탄소가 가진 수소의 수가 n일때, NMR 피크는 n+1개로 나누어진다는 원리이다. 예시로 아래의 그림 (c)를 확인해보자.

[그림 c] Spin splitting의 원리
위의 그림은 한 수소에 연결된 탄소에 이웃한 탄소가 가진 수소의 수가 3개일 때의 경우이다. 이 때 각 원자의 스핀 방향은 위 방향과 아래 방향이 가능하여 총 8가지의 경우의 수가 가능하다. 여기서 모든 원자의 스핀힘이 동일한 경우, 단 4가지만 존재하게 된다(모두 위인 경우, 두 개만 위인 경우, 한 개만 위인 경우, 모두 아래인 경우). 이중에서 두 개만 위인 경우와 한 개만 위인 경우는 각각 동일한 힘이 3가지씩이며, 이는 chemical equivalence에 의하여 같은 ppm에 누적이 되어 중첩 되어 1:3:3:1의 높이 비율을 가진 피크들이 나타난다. 같은 원리로 n=2일 때는 1:2:1비율, n=1일 때 1:1비율로 나타난다.
(9) Coupling
이웃한 탄소가 여러 개인 탄소의 경우에도 (n+1)법칙이 적용이 된다. 하지만, 이웃한 탄소가 두 개 이상일 때 각 탄소가 가진 수소의 전자밀도가 다른 경우 n+1법칙이 불가능하고 multiplet이 나오게 된다. 4J-coupling, w-coupling, Geminal coupling 등 다양한 현상과 현상 별 예상 및 계산 방법이 있지만, 매우 복잡하고 세부적인 내용이라 생략하겠다.
(10) 용매
NMR에는 다양한 용매들을 기준점을 나타내기 위하여 사용한다. 모든 용매 또한 수소 및 탄소, 산소 등 타겟 원소로 이루어져 있기 때문에 NMR에 관측된다. 따라서 물질 별로 영향이 제일 적은 용매를 사용하여야 한다. 보편적으로 NMR에 찍히지 않는 중수소를 사용한 용매들을 많이 사용한다. 예로 CDCl3, D2O, (CD3)2CO, DMSO-d6, toluene-d8이 있다.
Part 3 어떻게 적용이 가능한지
1) 분자 구조 확인
분자의 구조를 확인하는 것은 NMR의 주된 사용 목적으로 피크 분석을 통하여 분자 속 원자들간의 결합을 알아볼 수 있다. 특정 분자들간의 화합작용이 일어났는지, 어떤 작용을 했는지, 어떤 구조로 형성이 됐는지 확인할 수 있다. Chemical shift와 spin splitting을 통하여 그 원자의 근처 구조를 분석할 수 있고, integration curve를 통하여 원자핵의 수를 알 수 있다. 또한 reference로 비슷한 구조의 분자의 NMR이나 반응물의 NMR을 통하여 더 정확한 분석을 할 수 있다. 예시로 그림 (d)처럼 구성 원소의 종류와 수가 동일한 ethyl acetate와 methyl propionate의 비교를 NMR을 통해 할 수 있다. [c] 이중결합을 가진 산소에 의해서 전자 밀도가 달라져 a 피크의 위치가 변하게 되고, 이를 통하여 어떠한 분자인지 알 수 있다.

[그림 d] ethyl acetate와 methyl propionate의 NMR 데이터
2) 원자 수 비율 분석
NMR의 integration curve를 통하여 알 수 있는 것으로, 높이 비를 통하여 특정 ppm을 가진 원자 수의 비율을 알 수 있다. 위에서 설명한 chemical equivalence 원리에 의해 피크의 높이는 특정 ppm에 해당하는 원자들의 수와 비례한다. 이를 응용하면 특정 원자의 수를 통하여 정량분석도 대략적으로 가능하며, 더 나아가 분자들의 비율을 알 수 있다. 예시로 그림 (e)처럼 특정 ppm의 원자 수를 알 수 있고, 여기서 choline chloride와 glycerol, 물의 비율을 알 수 있다. [d] 그림에서 h와 b의 값을 통하여 1:1로 들어가 있음을 알 수 있다.

[그림 e] Choline chloride와 glycerol, 물의 3상 DES NMR 분석 결과
3) 분자간 작용 확인
지금까지 위에서 논했던 NMR은 1D NMR를 핵심으로 다뤘다. 하지만 NMR에는 2D, 3D NMR이 존재한다. 2D NMR의 경우 다른 원자핵끼리의 작용이 나타나게 되며, 이 형태가 2차원이기 때문에 2D NMR이라고 불리고, 3차원으로 나타내는 3D NMR도 있다. 2D NMR은 검출할 수 있는 원자에 따라 다른 기기가 사용되며, 종류는 COSY, TCOSY, NOESY 등이 있다. 예시로 그림 (f)의 NOESY NMR처럼 결과를 통하여 어떠한 수소가 서로 가까운지, 어떤 작용을 하는지 알 수 있다. [d]
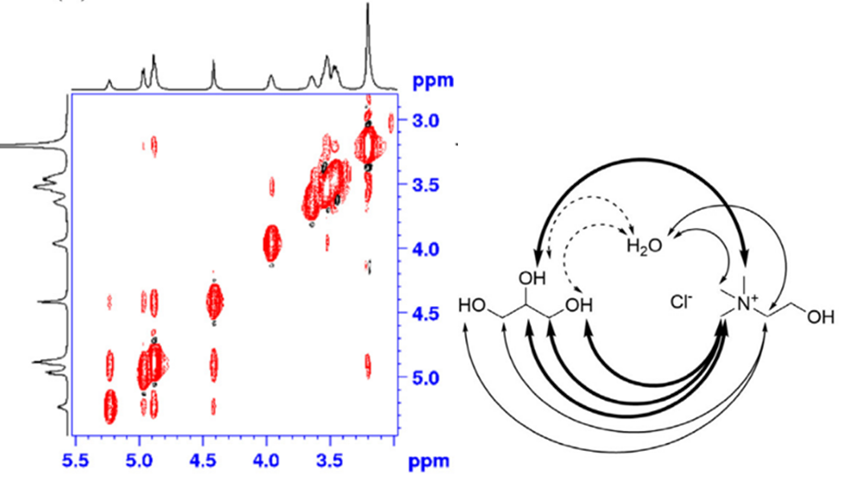
[그림 f] Choline chloride와 glycerol, 물의 2D-NOESY NMR 데이터
Reference
[a] “Basic One- and Two-Dimensional NMR Spectroscopy,” H. Friebolin, 5th Ed., VCH, 2010 (ISBN 3527327827)
[b] https://organicchemistrydata.org/hansreich/resources/nmr/?page=05-hmr-00-nmr%2F
[c] https://orgspectroscopyint.blogspot.com/2017/10/1h-nmr-spectra-of-c4h8o2-isomers.html
[d] NMR study of choline chloride-based deep eutectic solvents. Journal of Molecular Liquids. 290
