Superbase Ionic Liquid-Based Deep Eutectic Solvents for Improving CO2 Absorption
Hong Yan, Lei Zhao, Yinge Bai, Fangfang Li, Haifeng Dong, Hui Wang, Xiangping Zhang, Shaojuan Zeng(2020) ACS Sustainable Chem. Eng. 8, 2523-2530
I. Introduction
현재 산업 amine-based solvents사용
(ex. monoethanolamine (MEA), diethanolamine (DEA), diglycolamine (DGA), N-methyldiethanolamine (MDEA))
but 재생시 organic amine 손실, 높은 에너지 손실 발생
-> IL 사용 (무시할 수 있는 증기압, 쉽게 구조 변경 가능, CO2 친화도 높음)
but 높은 점도 -> masstransfer방해 -> organic solvent로 점도 낮추는 연구
-> DES 사용 (범위 넓음, CO2 친화도 매우높음, IL과 비슷하게 낮은 변동성)
지금까지 Choline Chloride 많이 사용됨
MEA–DES 높은 점도, 100℃ 탈거온도
이 논문 3개 SuperBase ILs + EG 사용할 것
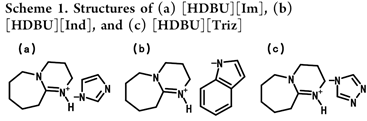
1) 1,8-diazabicyclo- [5,4,0]undec-7-ene imidazole ([HDBU][Im])
2) 1,8-diazabicyclo[5,4,0]undec-7-ene indole ([HDBU][Ind])
3) 1,8-diazabicyclo[5,4,0]undec-7-ene 1,2,4-triazole ([HDBU]-[Triz])
II. Experimental Section
1. IL 제작
참고문헌에 제시
[HDBU][Im]예시
1) Im(0.5mol) + 50ml ethanol
2) DBU 같은몰수 추가 후 stirring (상온, 상압 24h)
3) 가열 rotary evaporator 55℃ 4h
4) 진공건조 55℃ 40h -> IL완성
2. DES 제작
1) ILs + EG (mass비율)
2) stirring 50℃ 4h
3. 측정
FTIR
1H, 13C NMR - deuterated chloroform (CDCl3)
DMA, AMVn -> 점도, 밀도 -> 20~80℃
Mettler Toledo DSC1 -> 유리전이온도 -> -120 to 50 °C, 10 °C/min가열 N2 condition
4. CO2 흡수, 탈거
무게 재는 방식
DES 5g
CO2 200ml/min (40~80℃, 상압)
CO2 압력조절 -> N2 비율 조절로 분압 조절
탈거 N2 100ml/min 70℃
III. Result
1. SuperBase IL
1) 점도, 밀도
20~80℃ 측정
점도 밀도 전부 [HDBU][Triz] > [HDBU][Ind] > [HDBU][Im] 순
[HDBU][Im] 기존의 모든 ILs보다 점도 매우 낮음
[HDBU][Triz] 반대로 매우 높은 점도 보여줌
2) 흡수
[HDBU][Im] > [HDBU][Ind] > [HDBU][Triz]
-> 점도 높으면 흡수 덜, 낮으면 흡수 잘함 but 비율 그대로 가는 것 아님
[HDBU][Im]-CO2 CO2 흡수할수록 점도 높아져서 흡수시간 매우 길어짐 (1200min)
2. IL base DES
1) 물성
HBA로 superbase ILs 3개 사용, HBD EG 사용
ILs : EG 비율에 따라 MP 다름
3개 ILs : EG = 7:3으로 했을 때 MP -81, -71, -88 °C
[HDBU][Im] : EG 질량비 다르게 했을 때(3:7, 4:6, 5:5, 6:4, 7:3) MP -103, -99, -94, -89, -88 °C 낮아짐
-> DES 형성 확인
2) CO2 흡수능
[HDBU][Im]/EG, [HDBU][Ind]/EG, [HDBU][Triz]/EG – 7:3, 40 °C, 100 kPa
EG 추가시 점도 낮아져 CO2 흡수속도 엄청 빨라짐 -> 40min
-> CO2 흡수해도 점도 조금만 오름
ex. [HDBU][Im]/EG 점도 31.48 -> 166.41 mPa.s 40℃
[HDBU][Im] 점도 높아져 젤처럼됨
흡수량 - [HDBU]-[Im]/EG > [HDBU][Ind]/EG > [HDBU][Triz]/EG
-> [HDBU][Im]/EG 연구에 사용
3) 질량비 별 흡수능
40℃ 상압
EG 자체 흡수량 매우 낮음 – 0.008g CO2/g EG 25℃, 100kPa
IL : EG에서 IL비율 높아질수록 흡수량 증가 (3:7 -> 7:3 사용시 0.064 -> 0.141)
흡수 속도는 변화X
-> [HDBU][Im] : EG = 7:3 연구에 사용
4) 온도와 압력에 따른 흡수능
(1) 온도
[HDBU][Im] : EG = 7:3 온도, 압력변화
온도 증가시 흡수능 감소 (40 ->80℃ 변화 0.141 -> 0.123, 100kPa)
-> CO2 흡수 발열반응 -> 흡수율 감소
but 온도증가 -> mass transfer 이득 -> CO2 포화시간 줄여줌
(2) 압력
압력 증가시 흡수능 증가 (20 -> 100kPa 변화 0.121 -> 0.141, 40℃)
어느정도 충분한 압력 가해주면 그 뒤로부터 변화 작아짐 -> 적당한 압력 필요 (압력 = CO2 농도
5) 재생
5번 흡수-탈거 실험 연속 진행
[HDBU][Im] : EG = 7:3, 탈거 70℃ N2 100kPa purging, 흡수 40℃ CO2 100kPa
-> 변화 거의 없음
FTIR 로 한번도 안쓴 [HDBU][Im]-EG 와 비교한 결과 탈거후 [HDBU][Im]-EG 구조 안바뀜
-> 탈거 완벽하게 됨
6) Mechanism
계산, FTIR, 13C NMR로 분석
번호 매긴거 안알려줬음....
가능한 메커니즘

(1) Quantum Chemistry Calculations
[HDBU][Im]-EG와 CO2 사이의 전이상태 및 product의 결합에너지와 Mechanism 계산
[HDBU][Im]-EG(7:3)에서 CO2 흡수 계산 수월히 하기 위해 ILs : EG = 1 : 2 mol ratio로 가정
경로 2가지
1) Route 1
energy barrier 3.66 kcal/mol
product : IL + carbonate -> -11.57 kcal/mol
2) Route 2
energy barrier 8.54 kcal/mol
product : EG + carbamate -> -3.41 kcal/mol
Route 1, Route 2 모두 energy barrier ref33보다 낮음 (29.32~32.08kcal/mol)
-> IL과 EG 모두 CO2와 반응함
(2) FTIR
IL, [HDBU][Im]-EG CO2 흡수전후, 순수 [HDBU][Im]-EG, EG 찍음
1207, 1286, and 1644 cm−1 new peak
1207 -> C6-N 해당 -> imidazole anion의 N과 CO2 반응하여 carbamate 형성
1286 -> C1-O 해당 -> EG와 CO2 반응하여 carbonate 형성
1664 -> C6=O or C1=O 해당 -> imidazole anion에서 형성된 carbamate나 EG에서 형성된 carbonate중 하나 발생 or 둘이 동시에 발생하고 한자리에 나타난 것 일수도
=>IL과 EG 동시에 CO2와 반응해 carbonate와 carbamate 형성 확인
(3) 13C NMR
IL, [HDBU][Im]-EG, EG 세 개 흡수 전후 찍음
[HDBU][Im]-EG CO2흡수 후 60.7, 66.9, 158.6, and 165.6 ppm new peak
60.7 -> EG의 C-2
66.9 -> EG의 C-3
158,6 -> C-1 carbonate의 carbonyl carbon
165.6 -> [Im]- anion과 Co2가 반응해서 생긴 carbamate
다른 peak들
anion [Im]‑의 carbon
21.8, 35.2, 42.6 ppm –upshifted-> 19.2, 31.9, 38.2 ppm,
-> new peak 증명해줌
(4) Mechanism
1) EG H IL의 N으로 이동( N electronegative ) -> IL + Route 1
2) IL + CO2 -> EG + Route 2
=> carbamate + carbonate 얻어짐
3. IL과 비교
IL보다 [HDBU][Im]-EG가 흡수량도 높고, 재생 performance(낮은 탈거온도)도 좋고

IV. Conclusion
CO2흡수능 향상을 위해 3가지 SuperBase IL과 EG 섞어 DES만듬
Melting Point, 여러 조건(IL조성, EG질량비, 온도, 압력)에 따른 CO2 흡수능, 재생능력, mechanism 연구함
[HDBU][Im]-EG (7:3)이 젤 좋은 성능 ( 0.141gCO2/gDES, 40℃ 100kPa)
5번 재생해도 안정
Mechanism은 IL(->carbamate)과 EG(carbonate) 동시에 CO2 흡수 가능함 보여줌
'논문분석' 카테고리의 다른 글
| 1,8-Diazabicyclo[5.4.0]undec-7-ene (DBU)와 이산화탄소와의 반응 (0) | 2021.12.24 |
|---|---|
| Cosolvent 폴리에틸렌 글리콜을 이용한 알칸올아민 내 CO2 흡수 및 탈착 과정의 역학 (0) | 2021.12.24 |
| EG 지원 DBU 기반 DES(깊은 공융 용매)에 의한 이산화탄소 고효율 흡수 (0) | 2021.12.24 |
| 에탄올아민계 DES(깊은공융용매)를 이용한 이산화탄소 흡수율 (0) | 2021.12.24 |
| CO2포집에 유용한 물질인 DES(깊은공융용매) (0) | 2021.12.24 |


